Numérations et répartition (ou différenciation) leucocytaire manuelles effectuées au microscope
Les cellules sanguines doivent être comptées dans une chambre ayant un volume connu et précis.
 |
La chambre de comptage de Neubauer comprend deux surfaces quadrillées de 9 mm2 chacune. |
Chambre de comptage de Neubauer avec lamelle rodée (vue supérieure)
Observez les deux secteurs de comptage en forme de croix |
|
| |
|
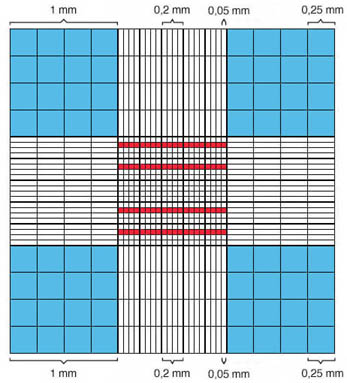 |
La grille comporte 9 grands carrés de 1 x 1 mm. Le carré central comprend 25 carrés de 0,2 x 0,2 mm, subdivisés eux-mêmes en 16 petits carrés de 0,05 x 0,05 mm. Les carrés colorés en rouge, au nombre de 80, servent aux comptages des érythrocytes et des plaquettes sanguines. Ils représentent 1/5 de 1 mm2. Les 4 carrés marqués en bleu sont utilisés pour la numération des leucocytes. |
Représentation schématique des secteurs de comptage de la chambre de Neubauer
en rouge: zones de comptage des érythrocytes et des plaquettes sanguines
en bleu: zones de comptage des leucocytes |
|
| |
|
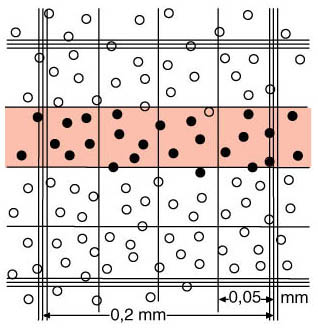 |
Les cellules sont comptées selon la règle en L qui consiste à considérer les éléments qui se trouvent à l'intérieur des carrés, ainsi que ceux qui sont en contact avec la ligne de gauche du premier carré et de la ligne inférieure. Les cellules en contact avec les lignes supérieure ou droite du dernier carré ne doivent pas être comptées.
 cercles pleins: cellules devant être comptées cercles pleins: cellules devant être comptées
 cercles vides: cellules ne devant pas être comptées. cercles vides: cellules ne devant pas être comptées. |
Représentation schématique d'un carré de 0.2 x 0.2 mm
de la chambre de Neubauer pour le comptage
des érythrocytes et des plaquettes sanguines |
|
| |
|
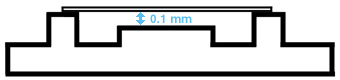
Représentation schématique d'une chambre de Neubauer (vue de profil)
en bleu: profondeur de la chambre |
Des supports entourant les deux surfaces servent à "coller" une lamelle rodée spéciale. Le volume final obtenu correspond à 0.1 ml pour un grand carré. Les anneaux de Newton (image en arc-en-ciel) confirment la bonne qualité de l'adhérence de la lamelle rodée, ce qui donne l'assurance d'un volume correct (1 mm x 1 mm x 0.1 mm = 0.1 µl). |

Photographie d'une chambre de Neubauer (vue de profil)
Observez la hauteur (0.1 mm) entre la chambre et la lamelle rodée |
Numération manuelle des érythrocytes
Le comptage des érythrocytes est effectué à une dilution de 1 : 200. Avec une pipette automatique, prélever 10 µl de sang sur EDTA que l'on dilue dans 1'990 µl de solution isotonique (par exemple, solution de Hayem). Bien mélanger, puis remplir la chambre de comptage. Attendre environ 3 minutes avant de procéder à la numération dans 80 petits carrés (4 lignes du carré central = 80 carrés/400 = 1/5 de mm2).
Les facteurs de correction prennent en considération:
- le nombre d'érythrocytes comptés dans les petits carrés
- la dilution: 1/200
- le nombre de carrés pris en compte: 80 petits carrés
- le volume de chaque carré compté: 0.00025 ml
- le facteur de conversion: de µl en l ; 1 µl = 10-6 l.
Le calcul final du nombre d'érythrocytes s'effectue de la manière suivante:
nombre d'érythrocytes comptés (I) x dilution (II) x facteur de conversion (V)
nombre de carrés pris en compte (III) x volume de chaque carré compté (IV) |
|
Exemple: comptage de 420 érythrocytes |
420 x 200 x 106
80 x 0.00025 |
= |
84'000 x 106
0.02 |
= |
4.2 x 1012/l ou 4'200'000 / ml |
Le coefficient de variation (CV) du comptage manuel des érythrocytes est de ±5% pour des techniciennes experimentées. Lors d'une polyglobulie, il est nécessaire d'utiliser une dilution plus élevée.
Numération manuelle des leucocytes
La numération des leucocytes est effectuée à une dilution de 1:20. Avec une pipette automatique, prélever 50 µl de sang sur EDTA que l'on dilue dans 950 µl de solution de Türk. Cette solution, qui contient de l'acide acétique et du violet de gentiane, lyse les érythrocytes et colore les leucocytes. Bien mélanger, puis remplir la chambre de comptage. Attendre environ 2 minutes avant de procéder à la numération dans 4 grands carrés (= 4 mm2).
Les facteurs de correction prennent en considération:
- le nombre de leucocytes comptées dans les grands carrés
- la dilution: 1/20
- le nombre de carrés pris en compte: 4 grands carrés
- le volume de chaque carré compté: 4 ml
- le facteur de conversion: de µl en l ; 1 µl = 10-6 l.
Le calcul final du nombre de leucocytes s'effectue de la manière suivante:
nombre de leucocytes comptés (I) x dilution (II) x facteur de conversion (V)
nombre de carrés pris en compte (III) x volume de chaque carré compté (IV) |
|
Exemple: comptage de 150 leucocytes |
150 x 20 x 106
4 x 0.1 |
= |
150 x 20 x 106
0.4 |
= |
7.5 x 109/l ou 7'500 / ml |
Le coefficient de variation (CV) du comptage manuel des leucocytes est de ±10% pour des techniciennes experimentées. En présence d'une leucopénie, il est recommandé soit de diminuer la dilution, soit de compter sur plus de 4 grands carrés. Lors d'hyperleucocytose, on augmentera en revanche la dilution. Ces mesures permettent d'améliorer la précision de la méthode.
Les érythroblastes, pris en compte lors de la numération leucocytaire manuelle ou effectuée par certains automates, donnent des résultats de comptages leucocytaires anormalement élevés. Le nombre d'érythroblastes ne peut être apprécié qu'à l'examen du frottis sanguin. Il est exprimé en nombre d'érythroblastes pour 100 leucocytes. Si la quantité d'érythroblastes est supérieure à 5 pour 100 leucocytes, une correction de la numération leucocytaire s'impose.
La formule de correction de la numération leucocytaire par déduction des érythroblastes est la suivante:
nombre de cellules nucléées (CN) x 100
nombre d'érythroblastes (ebl) pour 100 leucocytes + 100 |
|
Exemple: présence de 12 érythroblastes pour 100 leucocytes avec une numération leucocytaire de 5.6 x 109/l |
CN x 100
ebl + 100
|
= |
5.6 x 100
12 + 100
|
= |
560
112 |
= |
5.0 x 109/l ou 5'000 / µl |
Numération manuelle des plaquettes sanguines
La numération des plaquettes sanguines est effectuée à une dilution de 1:20. Avec une pipette automatique, prélever 50 µl de sang sur EDTA que l'on dilue avec 950 µl de solution spéciale pour le comptage plaquettaire (par exemple, Plaxan). Attendre 5 minutes, de manière à obtenir une lyse complète des érythrocytes. Bien mélanger, puis remplir la chambre de comptage. Comme les plaquettes sanguines sédimentent très lentement en raison de leur petite taille, laisser la chambre de comptage dans une boîte de Pétri renfermant des tampons humidifiés afin d'éviter le dessèchement, ceci pendant 20-30 minutes. La numération est identique à celle des érythrocytes. Compter les cellules dans 80 petits carrés.
Les facteurs de correction prennent en considération:
- le nombre de plaquettes sanguines comptées dans les petits carrés
- la dilution: 1/20
- le nombre de carrés pris en compte: 80 petits carrés
- le volume de chaque carré compté: 0.00025 ml
- le facteur de conversion: de µl en l ; 1 µl = 10-6 l.
La calcul final du nombre de plaquettes sanguines s'effectue de la manière suivante:
nombre de plaquettes sanguines comptées (I) x dilution (II) x facteur de conversion (V)
nombre de carrés pris en compte (III) x volume de chaque carré compté (IV) |
|
Exemple: comptage de 230 plaquettes sanguines |
230 x 20 x 106
80 x 0.00025 |
= |
230 x 20 x 106
0.02 |
= |
230 x 109/l ou 230'000 / ml |
Le coefficient de variation (CV) du comptage manuel des plaquettes sanguines est de ±10% pour des techniciennes expérimentées. Lors de thrombopénie, il est possible d'améliorer la précision, soit en comptant un nombre plus élevé de carrés, soit en diminuant la dilution (par exemple, 1:10).
Répartition (ou différenciation) manuelle des leucocytes
La répartition (ou différenciation) manuelle des leucocytes est effectuée sur un ou deux frottis colorés au May-Grünwald-Giemsa. Comme les leucocytes ne sont pas répartis de manière homogène sur l'ensemble du frottis, il est nécessaire de procéder à un examen "en créneaux" (voir schémas applicables aux deux méthodes de confection des frottis sanguins).
 |
 |
Répartition leucocytaire "en créneaux"
(à gauche, première méthode; à droite deuxième méthode de confection des frottis sanguins) |
La différenciation leucocytaire s'effectue sur 200 cellules (idéalement, 100 cellules sur deux frottis réalisés à partir du même échantillon sanguin). Lors de leucopénie, il est souvent impossible de compter plus de 100 leucocytes. En présence d'une hyperleucocytose, la répartition est effectuée sur 400 cellules. Les valeurs absolues sont obtenues en multipliant les pourcentages des populations leucocytaires par le nombre de leucocytes. Elles sont exprimées en 109/l.
Exemple: lymphocytes 20 %; leucocytes 6.0 x 109/l. Lymphocytose en valeur absolue: 0.2 x 6 = 1.2 x 109/l.
Le coefficient de variation de la répartition leucocytaire est fonction de deux paramètres: le nombre de cellules comptées et le pourcentage respectif des 5 ou 6 populations leucocytaires (6 si on différencie les neutrophiles non segmentés). Les valeurs relatives les plus faibles d'une différenciation leucocytaire normale concernent, dans l'ordre, les basophiles, les éosinophiles, les neutrophiles non segmentés et les monocytes. Consulter la table de Rümke.
Exemples: Pour une valeur relative des monocytes de 5 %, en effectuant une répartition sur 100 cellules, les résultats obtenus peuvent varier entre 1.6 et 11.3 %. En revanche, sur un automate qui examine 10'000 leucocytes, les valeurs se situent entre 4.5 et 5.5 %. Le même degré de variation est obtenu en comptant 500 cellules pour une population leucocytaire représentant 50% de la répartition.
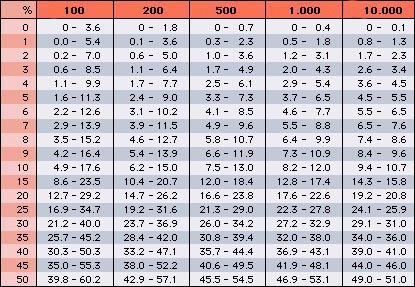 |
Table de Rümke
Variation des valeurs relatives d'une population leucocytaire selon le nombre de cellules comptées
(adaptée du CD-ROM "Das interaktive Handbuch der Hämatologie") |
Numération manuelle des réticulocytes
Les réticulocytes sont colorés sans fixation (coloration supravitale) soit avec du bleu de méthylène nouveau, soit avec du bleu brillant de crésyl. On procède ensuite à la confection d'un frottis sur une lame ordinaire. Le microscope est équipé d'un oculaire spécial afin que le champ de vision soit réduit à un petit carré. Les réticulocytes sont aisément identifiables, l'ARN conférant aux érythrocytes un aspect réticulé.
Plus le pourcentage de réticulocytes est faible, plus le coefficient de variation de la méthode est élevé. Sur 1000 érythrocytes examinés, le coefficient de variation est de ±10% pour une valeur relative de réticulocytes se situant dans les intervalles de référence (1-2 %).
Etabli le 3.6.2000, modifié le 3.8.2000, remarques à Dr méd. U. Woermann







