Leucémie chronique à éosinophiles (CEL)
Brève description:
La leucémie à éosinophiles chronique (LEC) appartient au groupe des néoplasies myéloprolifératives chroniques. Une prolifération clonale autonome des précurseurs éosinophiles en est à l’origine. On observe une prolifération des éosinophiles dans le sang, la moelle et parfois dans les organes périphériques. On suspecte occasionnellement un syndrome myéloprolifératif, sans que la clonalité ou une prolifération de blastes soit identifiable. La maladie est classée dans ce cas dans les syndromes hyperéosinophiliques (SHE). Si la présence d’un gène de fusion BCR-ABL peut être démontrée, il s’agit d’une leucémie myéloïde chronique.
Aspect clinique:
Des lésions organiques peuvent survenir à la suite d’une infiltration d’organes ou par diverses substances libérées (cytokines, enzymes, autres protéines). On craint surtout la cardiomyopathie avec lésion des valves cardiaques, qui peut parfois atteindre rapidement des dimensions potentiellement fatales. On ne peut prévoir le moment de la lésion d’organe et quand celle-ci fait défaut.
Aspect hématologique:
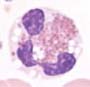
Les granulocytes éosinophiles sont habituellement nettement augmentés dans le sang. Par définition, leur numération est d’au moins 1.5 x109/l. Du point de vue cytologique, les cellules ont un aspect normal. Des blastes peuvent être présents, mais restent à <20%.
Aspect de la moelle osseuse:
Les granulocytes éosinophiles et les précurseurs des éosinophiles sont en nombre augmenté mais ne présentent en général aucune anomalie morphologique. Des blastes peuvent être présents, mais restent à <20%.
Diagnostic:
Selon la classification OMS, on peut retenir le diagnostic de LEC si les granulocytes éosinophiles dans le sang sont à >1.5 x 109/l et que la clonalité des éosinophiles est démontré ou qu’il y a une prolifération de blastes (>2% dans le sang, >5% dans la moelle). Les blastes ne doivent cependant pas dépasser 20% dans le sang et la moelle. Il faut exclure une polycythémie vraie, une thrombocythémie essentielle, une myélofibrose, une leucémie myélomonocytaire chronique ou une LMC atypique. Une inversion (16), un gène de fusion BCR-ABL ou des réarrangements de PDGFRalpha, PDGFRbeta ou FGFR1 ne doivent pas être présents.
Les néoplasies myéloïdes et lymphoïdes avec éosinophilie et présence d’un réarrangement de PDGFRalpha, PDGFRbeta ou FGF1 sont attribuées dans la classification OMS à une catégorie de néoplasies myéloïdes propre. On parle de «néoplasies myéloïdes/lymphoïdes avec éosinophilie et aberrations de PDGFRalpha, PDGFRbeta ou FGFR1». Formellement, il s’agit toutefois surtout d’un tableau de leucémie éosinophile chronique. La forme la plus fréquente dans ce groupe est causée par la fusion génétique FIP1L1-PDGFRalpha, qui peut être mise en évidence par PCR ou FISH. Les maladies avec réarrangement de PDGFRalpha ou PDGFRbeta sont intéressantes car elles répondent excellemment bien à l’inhibiteur de la tyrosine kinase imatinib (Glivec®).